[프라임경제] 강스템바이오텍(217730)은 지난 26일 계열사 프리모리스테라퓨틱스의 엑소좀 기반 화상치료제 'PMS-101'이 호주 식품의약품안전청(이하 TGA)으로부터 1·2a상 임상시험계획(CTN)을 승인받았다고 1일 밝혔다.
호주 CTN은 임상시험 개시를 위한 절차로 국내 임상시험계획(IND)과 동일하게 허가기관으로부터 승인 후 임상시험에 돌입할 수 있다.
PMS-101은 줄기세포 유래 엑소좀 기반 화상치료제다. 엑소좀은 조직재생 및 염증억제 효능이 뛰어나, 손상부위의 염증 반응 후 피부조직이 재생되면서 치유되는 화상 치료에 매우 효과적이다.
특히 기존 출시된 피부세포를 활용한 화상치료제는 고가의 가격 대비 일반 드레싱 치료와 비교해 효능이 뛰어나지 않아, 의료현장에서 환자에게 적극적으로 처치하는 데 한계가 있다.
이에 프리모리스테라퓨틱스는 하이드로겔 패치 제형으로 화상 부위의 조직재생을 촉진함으로써 현재 화상 표준 치료법인 드레싱 대비 피부가 재건되는(재상피화) 시간을 단축시켰다.
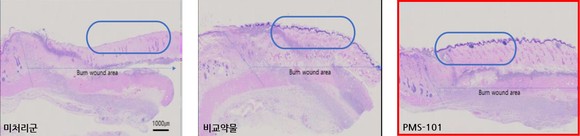
또한 동물실험을 통해 PMS-101을 사용할 시 새로 성장하는 피부조직의 길이가 약물 미사용군 대비 45%, 현재 치료에 적용되는 약물 대비 23% 증가한다는 데이터를 확보했다.
더불어, 프리모리스테라퓨틱스는 높은 효능의 화상치료제 개발을 위해 기존 엑소좀보다 세포성장, 재생 및 항염 기능을 강화한 엑소좀 'ExoPlus™'를 개발했으며, 강스템바이오텍의 위탁생산(CMO)을 통해 100리터 스케일에 해당하는 대량생산공정을 구축해 후기 임상 및 상업화 시 품질관리 등 엑소좀 치료제의 난관 요소인 생산 리스크를 해소했다.
나규흠 프리모리스테라퓨틱스 대표는 "호주 임상시험은 미국의 임상규격을 지켜 수행할 경우 해당 데이터를 인정받아 추후 미국, 유럽 등 글로벌 임상 진행의 토대를 마련할 수 있다"며 "또한 국내 시장 점유를 위해 향후 치료제 개발 시 국내 최대 화상 전문 병원으로의 공급도 협의돼 있다"고 말했다.
이어 "빠른 상업화를 위해 임상 진입부터 추후 임상 진행방향 및 사업전략 등을 수립한 만큼 이번 임상 1·2a상에서 PMS-101의 안전성과 탐색적 유효성을 확보할 것이다"고 덧붙였다.
한편, 시장조사기관 데이터 브리지 마켓 리서치(Data Bridge Market Research)에 따르면 글로벌 엑소좀 치료제 시장은 연평균 성장률 21.9%로, 2026년 317억 달러 규모로 성장할 것으로 전망된다.